Kardi Raharjo
PT. Prana Ardita, Temanggung
Christanti Sumardiyono
Fakultas Pertanian Universitas Gadjah Mada
Nursamsi Poesposendjojo
Fakultas Pertanian Universitas Gadjah Mada
Sismindari
Fakultas Farmasi Universitas Gadjah Mada
ABSTRACT
Phyllosphere is one of habitat of yeast and the other microorganism included an antagonistic microorganism. The antagonistic yeasts have been isolated from watermelon phyllosphere on YM Agar medium. There are 30 isolates of yeast have been found.
The pure culture of virulent isolate I15 of C. lagenarium used for testing the antagonistic ability of yeast isolates. Two yeast isolates namely K10 and K35 have highest ability to inhibit growth and development of C. lagenarium colony. From microscopic observation, the isolates K10 and K35 caused deflated on C. lagenarium hyphe. The result of identification of K10 is Candida sp. and K35 is Sirobasidium sp
Keywords: yeast, Candida, Sirobasidium, Colletotrichum, watermelon
INTISARI
Filosfer merupakan salah satu habitat khamir dan mikroorganisme lain yang beberapa di antaranya merupakan mikroorganisme antagonis. Khamir antagonis terhadap C. lagenarium diisolasi dari filosfer semangka dengan medium YM Agar. Dari 30 isolat khamir yang diperoleh, diuji kemampuan antagonisme-nya pada Colletotrichum lagenarium isolat I15 yang virulen terhadap tanaman semangka. Dari hasil pengujian ini diketahui dua isolat khamir yakni K10 dan K35 mempunyai kemampuan tertinggi dalam menghambat pertumbuhan dan perkembangan C. lagenarium. Berdasarkan pengamatan mikroskopi diketahui terjadi parasitisme pada miselium C. lagenarium oleh isolat khamir K10 dan K35 dengan gejala pengempisan hifa.
Hasil identifikasi berdasarkan morfologi koloni, organ vegetatif, organ reproduksi aseksual dan seksual diketahui bahwa K10 adalah Candida sp. dan K35 adalah Sirobasidium sp.
Kata kunci: Khamir, Candida, Sirobasidium, Colletotrichum, semangka
*) Sebagian hasil penelitian untuk penyusunan disertasi pada Program Pascasarjana Universitas Gadjah Mada
PENGANTAR
Penyakit antraknos merupakan salah satu penyakit penting pada semangka (Sherf dan Macnab, 1986; Semangun, 1991; Sitterly dan Keinath, 1996). Penyakit ini sudah diketahui dan dilaporkan di Italia pada tahun 1867 (Sitterly dan Keinath, 1996). Menurut Sherf dan Macnab (1986) penyakit ini dapat menimbulkan kerugian ekonomi antara 30-35 persen.
Penyebab penyakit antraknos pada semangka adalah jamur Colletotrichum lagenarium (Sherf dan Macnab, 1986; O’Connell, 1991; Semangun, 1991;O’Connell, et al., 1992; Esquerre et al., 1992; Jeffries and Koomen. 1992; Sitterly dan Keinath, 1996) sinonim dengan C. orbiculare ( Sherf dan Macnab, 1986; Sitterly dan Keinath, 1996; Zitter, 1987; Zitter et al., 1998). Jamur ini membentuk stadium teleomorph dengan nama Glomerella lagenarium (Sitterly dan Keinath, 1996) sinonim dengan G. cingulata (Semangun, 1991), G. cingulata var orbiculare (Sherf dan Macnab, 1986) yang jarang dijumpai di alam.
Di Indonesia, belum pernah dilakukan penelitian pengendalian penyakit ini, terutama menggunakan mikroorganisme antagonis sebagai agen hayati. Campbell (1989) menyatakan bahwa pengendalian hayati mempunyai arti penting dalam upaya pengendalian penyakit tumbuhan karena mempunyai beberapa keunggulan antara lain biayanya murah, aman terhadap pekerja, konsumen produk pertanian, dan lingkungan serta mempunyai efek pengendalian yang berkelanjutan. Menurut Jacobsen (1997), dalam hubungannya dengan implementasi PHT (Pengendalian Hama Terpadu), pengendalian hayati merupakan salah satu komponen utama karena PHT merupakan konsep dengan pendekatan yang memaksimalkan peranan pengendalian alamiah .
Sebagai negara yang berada di daerah tropis, Indonesia memiliki potensi sumber keaneka-ragaman mikroorganisme yang tinggi, sehingga terdapat peluang yang besar untuk diperoleh mikroorganisme antagonis yang efektif untuk mengendalikan penyakit antraknos pada semangka.
Filosfer merupakan salah satu habitat mikroorganisme saprofit. Beberapa di antaranya merupakan mikroorganisme antagonis (Preece and Dickinson, 1971). Berdasarkan hasil penelitian yang dilakukan oleh Tantawi et al. (1993) terdapat 26 spesies jamur yang berhasil diisolasi dari daun karet yang berasal dari kebun pembibitan karet Pusat Penelitian Perkebunan Getas. Menurut Leben (1971) pada daun apel terdapat banyak spesies jamur benang dan khamir, di mana 80-90 % di antaranya merupakan khamir. Beberapa jenis khamir (Cryptococus infirmo-miniatus, C. laurentii, Rhodotorula glutinis) efektif untuk mengendalikan penyakit pascapanen pada buah pear (Benbow dan Sugar, 1999).
Sebagaimana telah dilaporkan oleh peneliti-peneliti sebelumnya bahwa mikroorganisme antagonis dapat menekan pertumbuhan dan perkembangan patogen melalui mekanisme antibiosis (pembentukan antibiotik, bakteriosin, toksin dan enzim hidrolisis), parasitisme, dan kompetisi (Wells, 1986; Cabib, 1987; Ohtakara et al., 1988; Crawford, 1999; Elad et al., 1999; Johnson dan Dileon, 1999; Mazzola, 1999; Raaijmakers et al., 1999; Sabaratnam, 1999; Singh et al., 1999; Xu et al., 1999; Yedidia et al., 1999; Zhang et al., 1999; Kriger, 2000; Mathivanan et al., 2000; Selitrennikoff, 2001; Suzuki et al., 2000; Tsujibo et al., 2000; Velazhahan et al., 2000; Yoon et al., 2001).
Sehubungan dengan hal tersebut di atas, akan dilakukan penelitian untuk mengeksplorasi dan menseleksi khamir antagonis dari filosfer yang efektif untuk menekan pertumbuhan dan perkembangan patogen antraknos (C. lagenarium).
BAHAN DAN METODE
1. Isolasi Khamir dari Filosfer
a. Pembuatan suspensi propagul khamir filosfer
Dua lembar daun semangka yang sehat diambil dari tanaman yang berumur 30-60 HST dari pertanaman semangka di kabupaten Temanggung, Purworejo, dan Magelang. Daun yang diambil adalah daun tertua karena pada daun tua terdapat populasi jamur dan khamir yang lebih tinggi dibandingkan dengan daun muda (Tantawi et al., 1993). Daun selanjutnya dipotong-potong dengan diameter 0,5 cm menggunakan bor gabus. Pada setiap daun diambil 5 potongan dari helaian bagian kanan dan 5 potongan dari helaian bagian kiri daun. Duapuluh potongan daun yang berasal dari 2 daun dari tanaman yang sama selanjutnya dimasukkan ke dalam 100 ml air steril dalam erlenmeyer 250 ml, kemudian dikocok pada meja shaker selama 30 menit untuk melepaskan mikroorganisme dari permukaan daun (Dickinson, 1971).
b. Satu ml suspensi propagul tersebut selanjutnya dicampur dengan medium YM agar (3 g ekstrak malt, 5 g peptone, 10 g glukosa, 20 g agar, 40 mg khloramfenikol, 1 l air) yang masih mencair (suhu ± 45 derajat C) dan kemudian dituangkan ke dalam petridis. Campuran tersebut diinkubasikan pada suhu kamar selama 24-48 jam. Semua koloni yang tumbuh yang diduga khamir dipisahkan satu dengan yang lain berdasarkan warna, bentuk, dan ciri-ciri yang lain (van der Walt dan Yarrow, 1987) dengan cara memindahkan pada medium yang baru. Reisolasi dilakukan 2-4 kali sampai diperoleh biakan murni. Penelitian ini dilakukan di Laboratorium PHPTPH Wilayah Kedu di Temanggung.
2. Pengujian Daya Antagonisme dan Gejala Parasitisme
Pengujian dilakukan dengan modifikasi metode yang dilakukan oleh Campbell (1989) dengan prosedur sebagai berikut:
a. Isolat mono spore lagenarium I15 yang telah diuji dalam penelitian sebelumnya dan terbukti mempunyai virulensi tertinggi diantara isolat yang diuji digunakan dalam penelitian ini Biakan murni C. lagenarium berumur 5 hari pada medium YM agar ditetesi dengan suspensi khamir dengan konsentrasi 10^6 sel/ml. Penetesan dilakukan menggunakan pipet mikro pada 5 posisi, masing-masing ditetesi dengan 0,02 ml suspensi (gambar 1). Tiap perlakuan terdiri dari tiga ulangan.
b. Luas koloni khamir dan lagenarium diukur menggunakan plastik transparan yang pada permukaannya telah dibuat garis membujur dan melintang yang membentuk kotak-kotak berukuran 1 x 1 mm.
c. Pengamatan parasitisme
- Secara makroskopis. Cara kontak antara koloni khamir dengan lagenarium: diamati pada areal yang saling bersinggungan.
- Secara mikroskopis. Pengamatan kontak antara sel khamir dengan hifa lagenarium: sel khamir menempel atau masuk ke dalam hifa C. lagenarium. Pengamatan dilakukan juga pada perubahan morfologi hifa jamur.
- Pengamatan dilakukan tiap hari sekali dimulai 3 hari setelah perlakuan sampai dengan 8 hari setelah perlakuan.
Dari data yang diperoleh dipilih khamir yang mempunyai daya penghambatan yang tinggi melalui mekanisme parasitisme. Penelitian dilakukan di Laboratorium PHPTPH Wilayah Kedu.
3. Identifikasi Khamir Antagonis Terpilih
Dua isolat khamir antagonis terpilih yang diperoleh dari kegiatan nomor 5 diidentifikasi sampai genus. Menurut van der Walt dan Yarrow (1987), khamir dapat diindentifikasi genusnya dengan pengamatan karakteristik:
A. Reproduksi aseksual (vegetatif)
- Cara reproduksi vegetatif
Reproduksi vegetatif dapat terjadi melalui proses pertunasan, pembelahan, atau gabungannya.
2. Karakteristik sel vegetatif
- Morfologi sel vegetatif pada media YM cair dan media YM padat.
- Pembentukan miselium semu (pseudomycelium) dan miselium sejati ( true mycelium), endospora aseksual, klamidospora, buluh kecambah, ballistospora.
B. Reproduksi seksual
- Karakteristik pembentukan askospora
- Karakteristik pembentukan basidiospora
Dari data tersebut di atas, selanjutnya khamir diidentifikasi menggunakan kunci determinasi seperti tertera pada lampiran II (van der Walt dan Yarrow (1987)
HASIL DAN PEMBAHASAN
1. Isolasi Khamir dari Filosfer
Dari kegiatan isolasi khamir dari daun semangka sehat menggunakan medium YM Agar telah diperoleh 30 isolat yakni K2, K3, K7, K8, K9, K10, K11, K13, K15, K17, K19, K21,K 22, K23, K24, K26, K29, K30, K31, K32, K34, K35, K36, K37, K38, K39, K40, K41, K42, dan K43. Tiga puluh isolat khamir ini digunakan untuk penelitian selanjutnya.
2. Pengujian Daya Antagonisme dan Gejala Parasitisme
a. Pengamatan makroskopis
Untuk menguji daya antagonisme isolat khamir digunakan isolat C. lagenarium I15 pada medium YM Agar. Tiap perlakuan terdiri dari 3 ulangan.
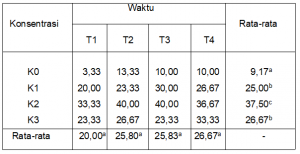
Berdasarkan pengamatan luas koloni C. lagenarium sampai dengan 8 hari setelah perlakuan, terdapat dua isolat khamir yakni K10 dan K35 yang menunjukkan kemampuan paling tinggi dalam menekan pertumbuhan dan perkembangan C. lagenarium (gambar 2 dan tabel 1).
Tabel 1. Luas koloni C. lagenarium (cm2) hasil pengujian parasitisme
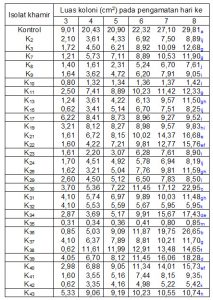
Keterangan: angka pada kolom yang sama yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata dengan uji Duncan pada taraf 5 %.
b. Pengamatan mikroskopis
Pengamatan mikroskopis gejala parasitisme dilakukan pada khamir terpilih (K10 dan K35), dengan hasil sebagai berikut:
Khamir K10
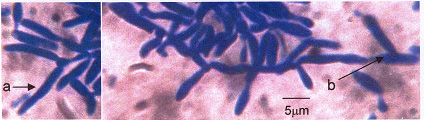
Berdasarkan pengamatan makroskopi pada bagian miselia C. lagenarium yang bersinggungan dengan koloni khamir K10 menunjukkan terjadinya perubahan warna dari semula putih berubah menjadi coklat (gambar 2 A). Bila miselia pada bagian ini diamati di bawah mikroskop tampak sel-sel khamir menempel pada hifa C. lagenarium yang menyebabkan hifa mengempis (gambar 3).
Khamir K35
Berdasarkan pengamatan makroskopi pada bagian miselium C. lagenarium yang bersinggungan dengan koloni khamir K35 menunjukkan terjadinya perubahan warna dari semula putih berubah menjadi hitam (gammbar 2 B). Bila miselium pada bagian ini diamati di bawah mikroskop tampak adanya gejala pengempisan hifa yang tidak merata sehingga tampak lekukan-lekukan (gambar 4).
2. Identifikasi Khamir Antagonis Terpilih
a. Khamir K10
- Morfologi koloni
Koloni khamir K10 berwarna kuning kecoklatan pada bagian pinggir dengan bagian tengahnya berwarna kuning tua sehingga membentuk lingkaran dalam lingkaran (gambar 5)
- Morfologi sel vegetatif
Morfologi sel khamir K10 pada media YM agar berbentuk lonjong dengan ujung runcing berukuran (1-1,5) x (5-9) μm, hialin, sel yang masih muda tidak bersekat setelah dewasa bersekat (gambar 6).
- Reproduksi aseksual
Berdasarkan pengamatan mikroskopis, khamir ini membentuk miselium semu (pseudomycelium) tipe Mycocandida yang membentuk blastospora (gambar 7).
Khamir K10 juga membentuk miselium sejati (true mycelium) yang bercabang-cabang dan arthrospora (arthrokonidia) yang terbentuk dari fragmentasi miselium sejati. Arthrospora berbentuk agak bulat dengan ukuran (1,5-2) x (5-6) μm, kemudian memanjang dan membelah diri (gambar 8).
Pembentukan tunas merupakan cara reproduksi yang paling penting pada khamir K10. Pada umumnya tunas dibentuk secara monopolar (gambar 9) dan kadangkala secara bipolar. Sel khamir dewasa tidak memperbanyak diri dengan pembelahan sel, kecuali pada sel arthrospora.
4. Reproduksi seksual
Pada khamir ini belum dijumpai adanya organ reproduksi seksual baik askospora maupun basidiospora.
- Nama genus khamir
Berdasarkan ciri-ciri morfologi koloni, bentuk sel khamir, dan bentuk blastospora tersebut di atas, khamir K10 mirip dengan Candida boidinii. Menurut Meyer et al. (1987) sel C. boidinii berbentuk oval lonjong sampai silindris atau kadang-kadang berbentuk agak bulat, ukuran (1,5-3-5) x (7-12) μm, koloni krem kekuningan, lembab sampai kering, lunak, lembut berkerut. Miselium semu terdiri dari hifa semu berukuran pendek sampai agak panjang, membentuk percabangan, dan memproduksi blastospora berbentuk oval.
Berdasarkan kemiripan antara khamir K10 dengan C. boidinii tersebut dapat disimpulkan bahwa khamir K10 adalah Candida sp (familia Cryptococcaceae, form-ordo Cryptococcales, sub kelas Blastomycetidae, kelas Deuteromycetes, sub devisi Deuteromycotina, devisi Amastigomicota, kingdom Myceteae).
b. Khamir K35
- Morfologi koloni
Koloni khamir K35 yang masih muda berwarna putih keunguan, kemudian berubah menjadi ungu dan akhirnya menjadi coklat kehitaman pada saat tua. Pada biakan murni pada umur 5 hari mulai membentuk benang-benang miselium berwarna putih (gambar 9).
- Morfologi sel khamir
Khamir K35 berbentuk batang pendek, ujung agak runcing sampai tumpul, hialin, dengan ukuran (2-3) x (4-5) μm (gambar 10).
- Reproduksi aseksual
Berdasarkan hasil pengamatan, khamir K35 dapat membentuk miselium semu yang tidak berlanjut dengan pembentukan blastospora. Miselium semu yang demikian disebut dengan buluh kecambah (germ tube). Khamir ini juga membentuk miselium sejati (gambar 11).
Arthrospora dibentuk oleh khamir ini dengan ukuran yang lebih panjang dari sel induk. Arthrospora ini selanjutnya memanjang lagi dan membelah menjadi dua sel (gambar 12). Cara reproduksi dengan pembelahan sel tidak hanya terjadi pada sel arthrospora namun juga terjadi pada sel khamir dewasa yang lain. Khamir ini juga membentuk balistospora (gambar 13). Pembentukan tunas pada khamir K35 merupakan cara reproduksi aseksual yang penting. Pembentukan tunas terjadi secara monopolar (gambar 14).
- Reproduksi seksual
Khamir K35 dapat membentuk basidium dengan 4 basidiospora. Basidium terbentuk pada basidiokarp pada sekat hifa sejati dengan ukuran (3-4,5) x (6-7,5) mm. Hifa sejati yang membentuk basidium mengalami pembesaran 5-6 kali diameter hifa normal. Pada tiap sekat hifa terbentuk dua basidia (gambar 15).
- Nama genus khamir
Berdasarkan bentuk sel khamir, basidiokarp, basidium dan basidiospora, dapat disimpulkan bahwa khamir K35 adalah Sirobasidium sp. (familia Sirobasidiaceae, ordo Tremellales, kelas Basidiomycetes, sub devisi Basidiomycotina, devisi Amastigomycota, kingdom Myceteae (Alexopoulos dan Mim, 1979; Bandoni, 1987 ).
KESIMPULAN
- Telah diperoleh 30 isolat khamir dari hasil kegiatan isolasi dari daun semangka yang diambil dari beberapa lokasi pertanaman semangka di kabupaten Temanggung, Magelang, dan Purworejo.
- Isolat khamir K10 dan K35 menunjukkan kemampuan menekan pertumbuhan dan perkembangan lagenarium yang paling tinggi dibandingkan dengan isolat lain yang diuji. Dua isolat ini menunjukkan kemampuan menimbulkan gejala parasitisme terhadap C. lagenarium yang berupa pengempisan hifa.
- Berdasarkan hasil identifikasi diketahui nama genus khamir K10 adalah Candida sp dan khamir K35 adalah Sirobasidium sp.
DAFTAR PUSTAKA
Benbow, J. M. and D. Sugar. 1999. Fruit Surface Colonization and Biological Control of Postharvest Diseases of Pear by Preharvest Yeast Application. Plant Disease 83(6): 839-844.
Cabib, E. 1987. The Synthesis and Degradation of Chitin. In A. Meister (ed.). Advances in Enzymology. And Related Area of Molecular Biology. John Wiley & Sons. New York, Toronto. 59-101 pp.
Campbell, R. 1989. Biological Control of Microbial Plant Pathogens. Cambridge University Press, Cambridge, New York, Sydney.169-183 pp.
Crawford, D. L. 1999. Mechanism of Biocontrol of Fungal Root Pathogens in The Rhizosphere by Streptomyces lydicus WYEC108. Dissertation Abstracts. University of Idaho. 70 p.
Dickinson, C. H. 1971. Cultural Studies of Leaf Saprophytes. In T. F. Preece and C. H. Dickinson (Eds.). Ecology of Leaf surface Microorganism. Academic Press. London. New York. 129-157 pp.
Elad, Y., D. R. David, T. Levi, A. Kapat, B. Kirshner, E. Guvrin and A. Levine.1999. Trichoderma harzianum T 39. Mechanisms of Biocontrol of Foliar Pathogens. In I. Lyr, P. E.
Russell and H. B. Modern (Eds.). Fungicide and Antifungal Compounds II. 12th International Reinhardsbrunn Symposium May 24 th – 29 th 1999. Friedrichroda, Thuringia, Germany. Intercept, Andover, Hants, SP 10 1YG, UK. 459-467 pp.
Esquerre-Tugaye, M. T., D. Mazau, J. P. Barthe, C. Lafitte, and A. Touze. 1992. In Colletotrichum. In J. a. Bailey and M. J. Jeger (eds.). Colletrotichum: Biology, Pathology and Control. CAB International. Melksham. 67-87 pp.
Jacobsen, B. J. 1997. Role of Plant Pathology in Integrated Pest Management. Annu. Rev. Phytopath. 35: 373-391.
Jeffries, P. and I. Koomen. 1992. Strategies and Prospects for Biological Control of Diseases Caused by Colletotrichum. In J. A. Bailey and M. J. Jeger (Eds.). Colletotrichum. Biology, Pathology And Control. C. A. B. International. Melksham. 337-357 pp.
Johnson, K. B. and J. A. Dileon. 1999. Effect of Antibiosis on Antagonist Dose Plant Disease Response Relationships for the Biological Control of Crown Gall of Tomato and Cherry. Phytophatology 89(10): 974-980.
Kriger, P. S. 2000. Regulation of Alpha-1,3-glucanase and Other Polysaccharide-degrading Enzymes From Trichoderma harzianum. Dissertation Abstracts. The University of Rochester. 218 p.
Leben, C. 1971. The Bud in Relation to Epiphytic Microflora. In T. F. Preece and C. H. Dickinson (eds.). Ecology of Leaf Surface. Academic Press. New York. 117-127 pp.
Mathivanan, N., V. Kabilan, and K. Murugesan. 2000. Purification, Characterization, and Antifungal Activity of Chitinase from Fusarium chlamydosporum, A Mycoparasite to Groundnut Rust, Puccinia arachidis. Can. J. Microbiol. 44(7): 646-651.
Mazzola, M. 1999. Transformation of Soil Microbial Community Structure and Rhizoctonia-Suppressive Potential in Response to Apple Roots. Phytophatology 89(10): 920-927.
Meyer, S. A., D. G. Ahearn, and D. Yarrow. 1987. Candida Berkhout. In N. J. W. Kreger-van Rij (ed.). The Yeast, A Taxonomic Study. Third Revised and Enlarger Edition. Elsevier Science Publishers B. V. Amsterdam. 585-844.
O’Connell, R. J. 1991. Cytochemical Analysis of Infection Structures of Colletotrichum lindemuthianum Using Fluorochrome-labelled Lectins. Physiol. Mol. Plant Pathol. 39 (5):189-200.
O’Connell, R. J. , C. Nash and J. A. Bailey. 1992. Lectin Cytochemistry: A New Approach to Understanding Cell Differentiation, Pathogenesis And Taxonomy. In Colletotrichum. In J. a. Bailey and M. J. Jeger (eds.). Colletrotichum: Biology, Pathology and Control. 67-87 pp.
Ohtakara, A., M. Izume and M. Mitsutomi. 1988. Action Microbial Chitinases on Chitosan with Different Degrees of Deacetylation. Agric. Biol. Chem. 52(12): 3181-3182.
Preece, T. F. and C. H. Dickinson. 1971. Ecology of Leaf Surface Microor-ganism. Academic Press. London. New York
Raaijmakers, J. M. R. , R. F. Bonsall, and D. M. Weller. 1999. Relationship Beetween Root Colonization and In Situ Antibiotic Production by Pseudomonas fluorescens. Phytopathology 89(6): abstract supplement S63.
Sabaratnam, S. 1999. Biological Control of Rhizoctonia Damping-Off of Tomato With a Rhizosphere Actinomycete. Dissertation Abstracts. The University Of Western Ontario, Canada. 209 p.
Selitrennikoff, C. P. 2001. Antifungal Protein. Appl. Environ. Microbiol. 67(7):2883-2894 pp.
Semangun, H. 1991. Penyakit-penyakit Penting Tanaman Hortikultura Di Indonesia. Gadjah Mada University Press. Yogyakata. 850 p.
Sherf, A. F. and A. A. Macnab. 1986. Vegetable Diseases and Their Control. Second Edition. Jhn Wiley & Sons. New York.
Singh, P. P. , Y. C. Shin, C. S. Park ,and Y. R. Chung. 1999. Biological Control of Fusarium Wilt of Cucumber by Chitinolytic Bacteria. Phytopathology 89(1): 92-99.
Sitterly, W. R. and A. P. Keinath. 1996. Antracnose. In Compendium of Cucurbit Diseases. APS Press. New York.
Suzuki, K. , T. Uchiyama, M. Suzuki, N. Nikaidou, M. Regue, and T. Watanabe. 2000. LysR-type Transkripsional Regulator ChiR is Essential for Production of All Chitinase and A Chitin-Binding Protein, CBP 21, in Serratia marcescens 2170. Biosci. Biotechnol. Biochem. 65(2): 338-347.
Tantawi, A. R. , A. Harsojo, H. Semangun. 1993. Jamur Filoplan Tanaman Karet. Tesis S2 Program Pascasarjana UGM. Yogyakarta.
Tsujibo, H. T. Okamoto, N. Hatano, K. Miyamoto, T. Watanabe, M. Mitsutomi, and Y. Inamori. 2000. Family 19 Chitinase from Streptomyces thermovilaceus OPC-520: Molecular Cloning and Characterization. Biosci. Biotechnol. Biochem. 64(11): 2445-2453.
Van der Walt, J. P. and D. Yarrow. 1987. Methods for the Isolation, Main- tenance, Classification and Identification of Yeast. In N. J. W. Kreger-van Rij (ed.). The Yeasts. A Taxonomic Study (third revised and enlarged edition). Elsevier Science Publisers B. V. Amsterdam. 45-104 pp.
Velazhahan, R., R. Samiyappan, and P. Vidhyasekaran. 2000. Purification of Elicitor-Inducible Antifungal Chitinase from Suspension-Cultured Rice Cells. Phytoparasitica 28 (2): 1-9
Wells, H. D. 1986. Trichoderma as A Biocontrol Agent. Dalam K. G. Mukerji and K. L. Garg. CRC Press, Inc, Boca Raton, Florida. 71-82 pp.
Xu, T. , G. E. Harman, Y. L. Wang, and Y. Shen. 1999. Bioassay of Trichoderma harzianum strains for Control of Rice Sheath Blight Phytopathology 89(6): abstract supplement S86.
Yedidia, I., N. Benhamou, and I. Chet. 1999. Induction of Defence Respone in Cucumber Plants (Cucumis sativus L.) by The Biocontrol Agent Trichoderma harzianum. Appl. Environ. Microbiol 65(3):1061-1070.
Yoon, H. G., H. Y. Kim, H. K. Kim, B. S. Hong, D. H. Shin, and H. Y. Cho. 2001. Thermostable Chitosanase From Bacillus sp. Strain CK4: Its Purification, Characterization, and Reaction Patterns. Biosci. Biotechnol. Biochem., 65 (4): 802-809.
Zhang, J. X. ,B. D. Bruton, and C. L. Biles. 1999. Relationship of Cell Wall degrading Enzymes to Virulence of Didymella bryoniae. Phytophato-logy 89(6): abstract supplemet S89.
Zitter, T. A. 1987. Vegetable Crop. An Antracnose of Cucurbits. Cornell Univ. Ithaca, NY. Vegetable MD Online. http://ppathw3.cals.cornell.edu/extensio…ases/factsheets/cucurbit-antracnose.hatm.
Zitter, T. A., D. L. Hopkins, and C. E. Thomas. 1998. Compendium of cucurbit Diseases. APS Press. Minnesota.
LAMPIRAN
Gambar 1. Posisi penetesan suspensi khamir (kh) pada koloni C. lagenarium (cl)
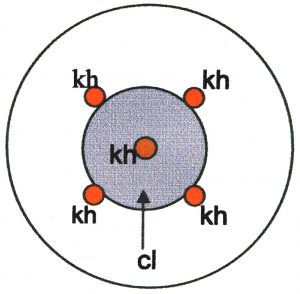
Gambar 1. Posisi penetesan suspensi khamir (kh) pada koloni C. lagenarium (cl)
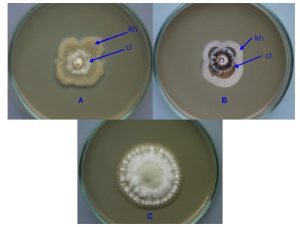
Gambar 2. Penghambatan pertumbuhan C. lagenarium oleh khamir K10 (A); K35 (B); dan kontrol (C) pada empat hari setelah perlakuan, khamir (kh), C. lagenarium (cl)
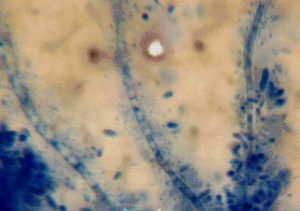
Gambar 3. Gejala parasitisme pada hifa C. lagenarium oleh khamir K10,: hifa terparasit oleh khamir (ht), hifa sehat (hs), sel khamir (kh), dan konidium C. lagenarium (ccl)

Gambar 4. Parasitisme pada hifa C. lagenarium oleh khamir K35 dengan gejala hifa mengempis (a) dan bagian hifa yang belum mengempis (b).
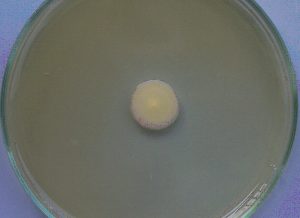
Gambar 5. Koloni khamir K10 umur 6 hari pada media YM agar
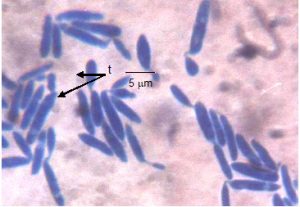
Gambar 6. Sel khamir K10 umur 6 hari pada media YM agar, tunas (t)
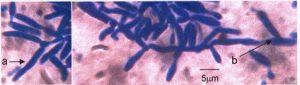
Gambar 7. Khamir K10: miselium semu yang memproduksi blastospora tipe blastodendrion: miselium semu pada pangkal (a) dan ujung (b) rangkaian blastospora.
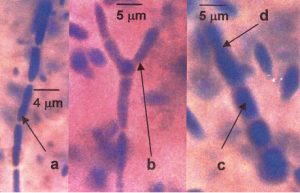
Gambar 8. Khamir K10: miselium sejati (a), miselium sejati yang bercabang (b), arthrospora (c), sel arthrospora pada bagian ujung yang memanjang dan akan membelah diri (d).
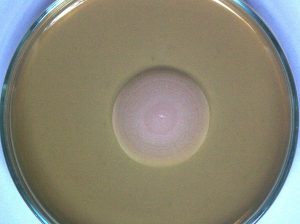
Gambar 9. Koloni khamir K35 umur 6 hari pada media YM agar.
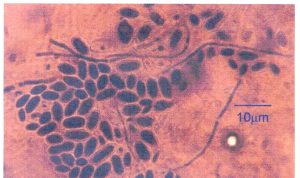
Gambar 10. Khamir K35 umur 6 hari pada media YM agar.
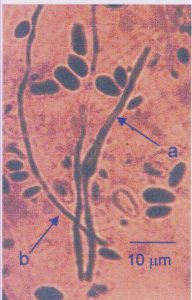
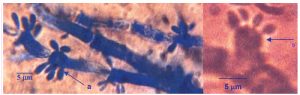
Gambar 11. Buluh kecambah (a) dan miselium sejati (b) pada khamir K35
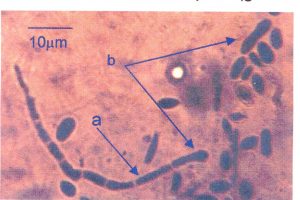
Gambar 12. Arthrospora (a) dan sel arthrospora yang memanjang dan membelah diri (b)
Gambar 13. Pembelahan sel (a), balistospora (b) pada khamir K35

Gambar 14. Pembentukan tunas pada khamir K35 secara monopolar
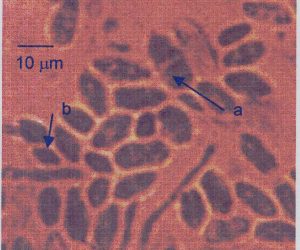
Gambar 15. Basidium pada sekat hifa (a), basidium dengan 4 basidiospora (b), pada khamir K35
For all of my friends, please visit and subscribe my YouTube Channel, so your comments are not be deleted from my articles :
https://www.youtube.com/channel/UCkxHAj1EOglKbk9fX4-H3rg







 Keterangan: Angka yang diikuti dengan huruf yang sama menunjukkan tidak beda nyata pada uji BNT taraf 5 %.
Keterangan: Angka yang diikuti dengan huruf yang sama menunjukkan tidak beda nyata pada uji BNT taraf 5 %.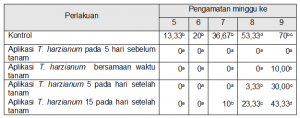







 Gambar 6. Gejala penyakit virus kuning pada gulma babandotan (Ageratum conyzoides).
Gambar 6. Gejala penyakit virus kuning pada gulma babandotan (Ageratum conyzoides).